 12
12
一类医疗器械产品备案和一类医疗器械生产备案是一类医疗器械的*资质。可以在国家市场监督管理局里查到是否是真是的
所需材料:
一般情况:
1.《类医疗器械生产备案表》 (原件正本(收取)1份,电子件1份)
2.所生产产品的医疗器械备案凭证及信息表复印件 (电子件1份,复印件1份)
3.经备案的产品技术要求复印件 (电子件1份,复印件1份)
4.营业执照和组织机构代码证复印件 (电子件1份,复印件1份)
5.法定代表人、企业负责人明复印件 (电子件1份,复印件1份)
6.生产、质量和技术负责人的身份、学历明复印件 (电子件1份,复印件1份)
7.生产管理、质量检验岗位从业人员、学历职称一览表 (原件正本(收取)1份,电子件1份)
8.生产场地的文件(有生产环境要求的,还应提交设施、环境的文件)复印件 (电子件1份,复印件1份)
9.主要生产设备和检验设备目录 (电子件1份,复印件1份)
10.质量手册和程序文件 (电子件1份,复印件1份)
11.工艺流程图 (电子件1份,复印件1份)
国家药品监督管理局对同时符合下列情形的医疗器械按本程序实施审评审批:
申请人经过其技术创新活动,在中国依法拥有产品核心技术发明权,或者依法通过受让取得在中国发明权或其使用权;或者核心技术发明的申请已由行政部门公开。
产品主要工作原理/作用机理为国内创,产品性能或者安全性与同类产品比较有根本性改进,技术上处于国际水平,并且具有显著的应用价值。
申请人已完成产品的前期研究并具有基本定型产品,研究过实和受控,研究数据完可溯源。
申请材料存在可以当场更正的错误的,应当允许有权更正人当场予以更正,由更正人在更正处签名或者盖章、更正日期;经确认申请材料齐全,符合法定形式的,应当决定予以受理。申请材料不齐全或者不符合法定形式的,应当当场告知申请人需要补正的全部内容。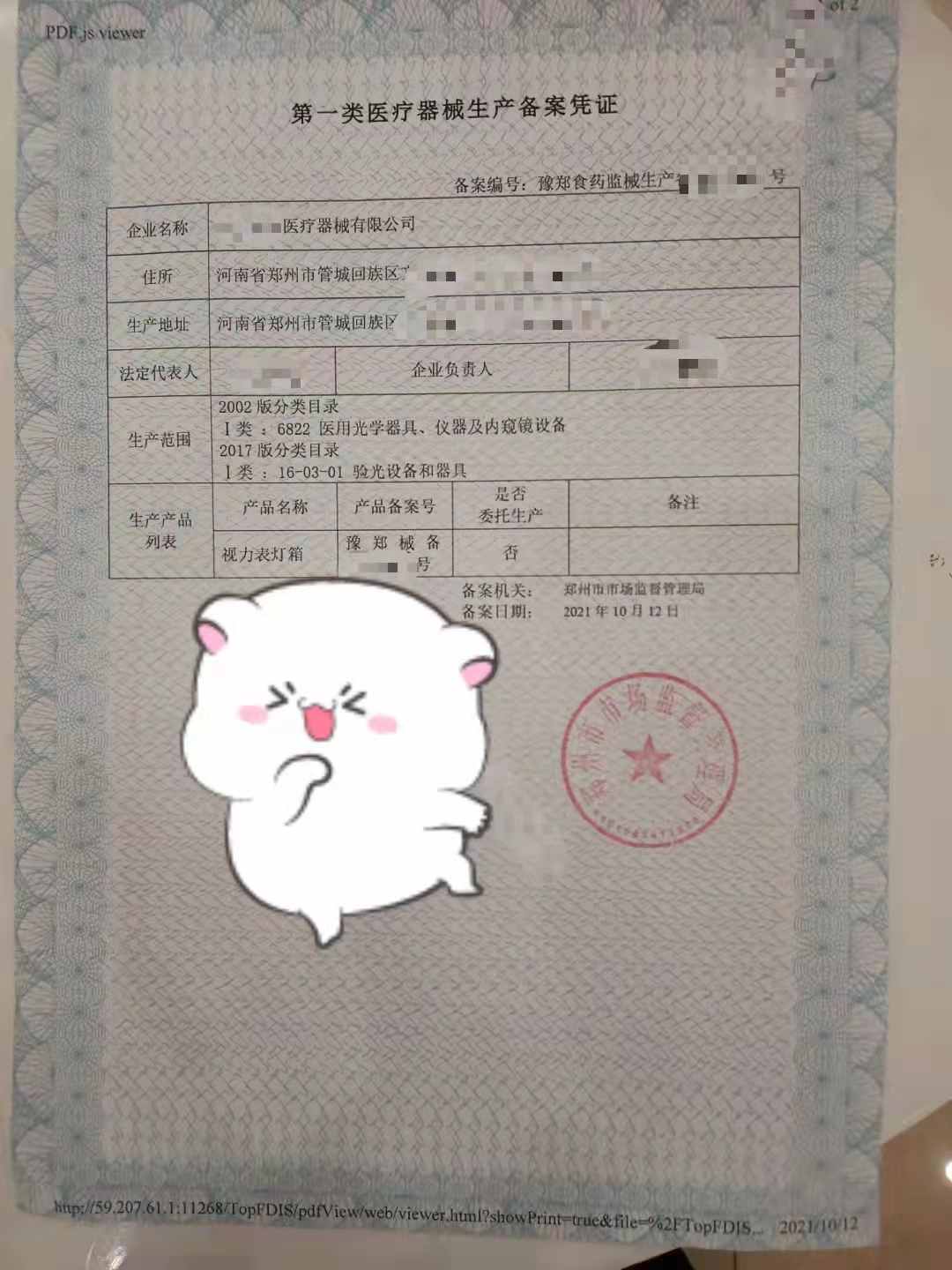
申请人的申请符合法定条件、标准的,行政机关应当依法作出准予行政许可的书面决定。 行政机关依法作出不予行政许可的书面决定的,应当说明理由,并告知申请人享有依法申请行政复议或者提起行政诉讼的权利。
河南艳阳雨13年经验,质量为准,效率争先
http://tplf02.cn.b2b168.com
欢迎来到河南艳阳雨企业管理咨询有限公司网站, 具体地址是河南省郑州金水区东风路13号附1号天明森林国际公寓1号楼12层160号,联系人是杨经理。
主要经营河南艳阳雨企业管理咨询有限公司主要从事:二类医疗器械备案凭证、网络文化经营许可证、出版物经营许可证、互联网药品信息服务许可证等办理流程理业务,以真诚的心态,对待每一位客户,热情的服务,对待每一位客户的咨询。
。
单位注册资金单位注册资金人民币 100 万元以下。
你有什么需要?我们都可以帮你一一解决!我们公司主要的特色服务是:二类医疗器械备案凭证,河南艳阳雨企业管理咨询有限公司等,“诚信”是我们立足之本,“创新”是我们生存之源,“便捷”是我们努力的方向,用户的满意是我们较大的收益、用户的信赖是我们较大的成果。